Butyrat: Ein Schlüsselmetabolit des Darmmikrobioms
Unser Darmmikrobiom ist ein dynamisches Ökosystem, das die menschliche Gesundheit maßgeblich beeinflusst. Während Probiotika lange Zeit den Markt für Darmgesundheitsprodukte dominierten, hat sich der Fokus zunehmend auf funktionelle Metaboliten wie kurzkettige Fettsäuren (SCFAs, englische Abkürzung für short chained fatty acids) verlagert. Unter diesen sticht Butyrat aufgrund seiner vielseitigen Vorteile hervor.
Im vorangegangenen Blogbeitrag sind wir auf die Rolle von Sauerstoff bei der Dysbiose eingegangen – und die Butyrat bei der Behebung der Darmdysbiose helfen kann. In diesem Beitrag beleuchten wir die Rolle von Butyrat für unsere Darm- und systemische Gesundheit und geben praktische Strategien zur Verbesserung der Butyrat-Produktion.
Hinweis: Wie immer sind die Informationen in unserem Artikel von uns selbst recherchiert und geschrieben – ohne Beteiligung von ChatGPT und Konsorten. Viel Spaß beim Lesen!
Die wichtigste Erkentnisse vorab
- Die kurzkettige Fettsäuren Butyrat spielt für unsere Darmgesundheit und darüber hinaus eine wichtige Rolle.
- Anhand verschiedener Strategien lässt sich die Produktion von Butyrat im Dickdarm erhöhen.
- Bei der Supplementierung mit Butyrat gibt es einen wichtigen Aspekt zu berücksichtigen.
Was sind Metaboliten und wie tragen sie zur Darmgesundheit bei?
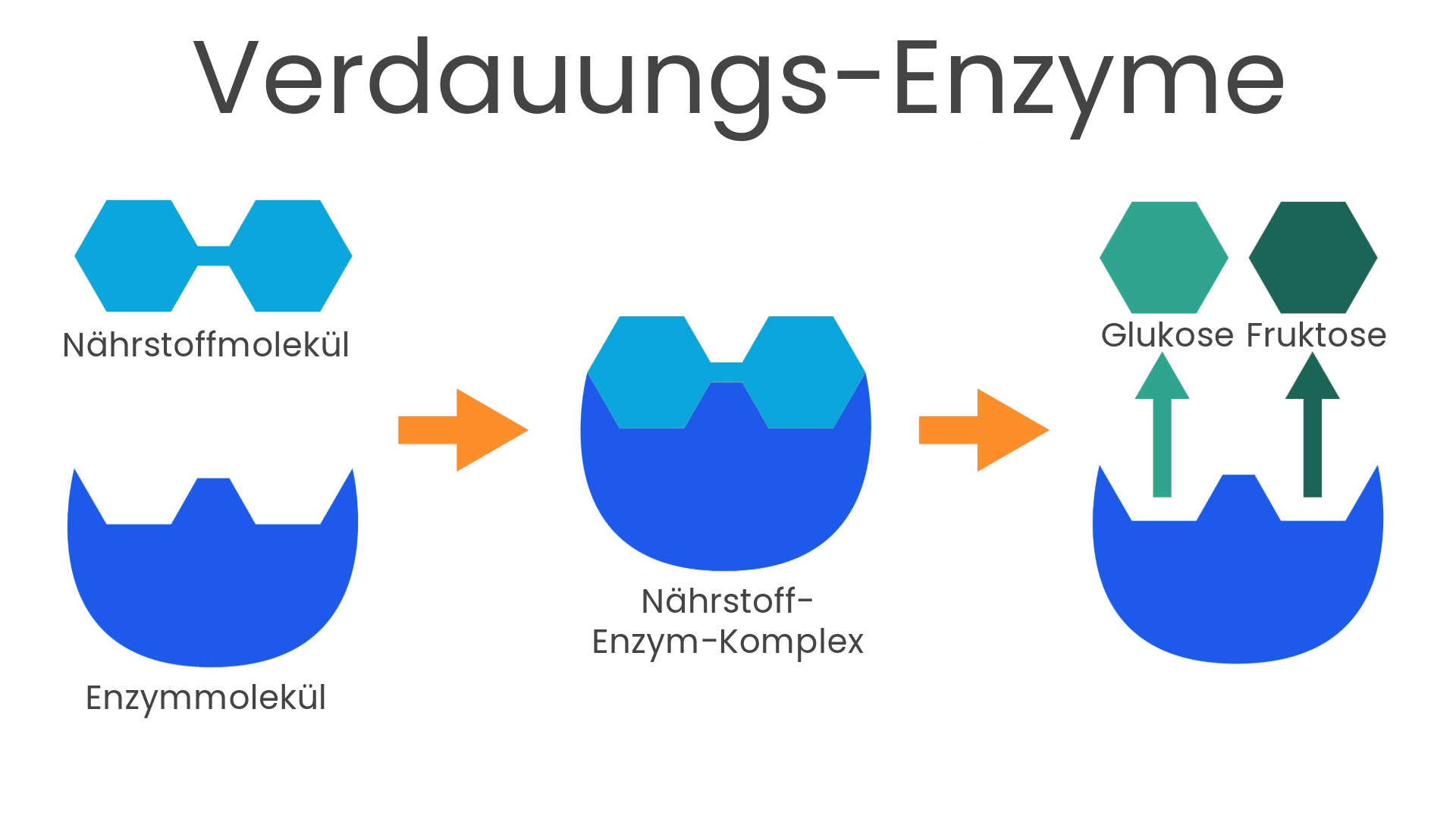
Metaboliten sind biochemische Verbindungen, die durch Stoffwechselprozesse in uns als Wirt und in unserem Darmmikrobiom entstehen. Bemerkenswerterweise gehen fast 46 % der in unserem Blutkreislauf zirkulierenden Metaboliten auf das Konto unseres Darmmikrobioms.1,2
Während nicht alle mikrobiellen Metaboliten von Vorteil für uns sind, wurden kurzkettige Fettsäuren wie Butyrat, Acetat und Propionat intensiv auf ihre positiven Gesundheitseffekte hin untersucht und stellten sich als sehr bedeutend für unsere Darmgesundheit heraus. Kurzkettige Fettsäuren entstehen hauptsächlich durch die Fermentation von Ballaststoffen, wie zum Beispiel partiell-hydrolysiertem Guarkernmehl (PHGG).3
46 % der im Blutkreislauf zirkulierenden Metaboliten gehen auf das Konto des Darmmikrobioms.
Deswegen ist Butyrat für die Darmgesundheit so wichtig
Butyrat spielt eine zentrale Rolle bei der Aufrechterhaltung der Darmintegrität und der allgemeinen Gesundheit durch mehrere Mechanismen:
-
Energiequelle für Kolonozyten:
Butyrat dient als primäre Energiequelle für Zellen der Darmschleimhaut und unterstützt deren Erneuerung und Funktion.4
-
Verbesserung der Darmbarriere:
Butyrat fördert die Schleimproduktion und stärkt die sogenannten Tight Junctions, die entscheidend sind, um das Durchdringen der Darmbarriere von Krankheitserregern zu verhindern.5
-
Regulierung des Sauerstoffgehalts:
Durch die Interaktion mit Rezeptoren in Kolonozyten trägt Butyrat dazu bei, niedrige Sauerstoffwerte im Darm aufrechtzuerhalten, wodurch das Wachstum von sauerstoffliebenden pathogenen Mikroben gehemmt wird (Genaueres dazu in unserem vorigen Beitrag).6 -
Immunmodulation:
Butyrat stimuliert regulatorische T-Zellen, reduziert Entzündungen und unterstützt das Immungleichgewicht, was besonders relevant ist, da sich 70–80 % der Immunzellen des Körpers im Darm befinden.7
Der über den Darm hinausgehende systemische Effekt von Butyrat
Die hier dargelegten Vorteile von Butyrat hören nicht bei unserer Darmgesundheit auf. Aktuelle Forschungsergebnisse zeigen, dass Butyrat darüber hinaus auch systemische Vorteile für unsere Gesundheit bieten kann – bzw. ein Mangel an Butyrat mit verschiedenen Erkrankungen in Verbindung gebracht wird:
-
Stoffwechselgesundheit
Eine reduzierte Anzahl Butyrat-produzierender Bakterien wird mit Stoffwechselerkrankungen wie Typ-2-Diabetes in Verbindung gebracht.8 Tierstudien legen nahe, dass Butyrat die Freisetzung der Hormone GLP-1 und PYY stimuliert, die eine Schlüsselrolle bei der Appetitregulation und dem Energiehaushalt spielen.8
-
Neurologische Gesundheit
Über die Darm-Hirn-Achse beeinflusst Butyrat die Produktion von Neurotransmittern (z.B. Dopamin, Noradrenalin) und neurotrophen Faktoren wie dem Brain-Derived Neurotrophic Factor (BDNF), welcher die Stimmung, das Lernen und das Gedächtnis unterstützt.9
-
Krebsprävention
Butyrat zeigt zudem antitumorale Eigenschaften, indem es Entzündungen reduziert, die Immunüberwachung verbessert und den Zelltod in Tumorzellen induziert.10
-
Allergieminderung
Studien legen nahe, dass Butyrat-produzierende Mikroben wie Clostridium butyricum und Anaerostipes caccae allergische Reaktionen verringern können, u.a. durch den Einfluss auf die Integrität und Funktion der Darmbarriere.11
Wie sich die Produktion von Butyrat verbessern lässt
-
Ernährung
Ballaststoffe, insbesondere präbiotische Fasern, sind das Futter für unsere Darmbaktieren und die Hauptsubstrate für die Butyrat-Produktion. Wichtige Quellen für präbiotische Ballaststoffe sind:
- Resistente Stärke (z.B. grüne Bananen, abgekühlte Kartoffeln, Vollkornprodukte)
- Lösliche Ballaststoffe (z.B. Hülsenfrüchte, Obst, Gemüse, Nüsse und Samen)
-
Lebensstil
Schlaf, Bewegung und Stressmanagement sind bekanntlich bedeutend für unsere Gesundheit – ebenso der umsichtige Einsatz von Antibiotika. Sie alle beeinflussen auch die Zusammensetzung des Darmmikrobioms und die Butyrat-Produktion erheblich12.
-
Probiotika
Spezifische Stämme wie Clostridium butyricum und Faecalibacterium prausnitzii können die Butyrat-Produktion fördern13.
-
Direkte Einnahme
Das Potenzial des Mikrobioms zur Produktion von Butyrat kann variieren. Die Einnahme großer Mengen an Ballaststoffen oder Präbiotika führt nicht automatisch zu einer signifikanten Erhöhung des Butyratspiegels14. Im Gegenteil: Eine zu schnelle Erhöhung der Ballaststoffzufuhr kann sogar zu gastrointestinalen Beschwerden führen. In solchen Fällen erscheint die Supplementierung mit Butyrat als sinnvolle Alternative.
Viele Butyrat-Nahrungsergänzungen enthalten Butyratsalze, wie beispielsweise Natriumbutyrat. Diese ermöglichen eine schnelle Aufnahme, erreichen jedoch oft nicht die Bereiche des Darms, in denen Butyrat am dringendsten benötigt wird – den unteren Dünndarm und den Dickdarm. Selbst bei magensaftresistenten Kapseln wird Natriumbutyrat in der Regel bereits im oberen Dünndarm freigesetzt und schnell resorbiert. Zwar kann dies den Zellen im oberen Dünndarm zugutekommen – doch besteht die Gefahr, dass bei einer hohen Dosis gleichzeitig zu viel Butyrat bereitgestellt wird. Dies kann negative Effekte auf die Erneuerung der Epithelzellen haben: das sogenannte Butyrat-Paradox15.
Der Butyrat-Vorläufer Tributyrin bietet hierfür eine besondere Lösung. Tributyrin besteht aus einem Glycerin-Rückgrat, an das drei Butyratmoleküle gebunden sind. Durch die Verkapselung von Tributyrin in magensaftresistenten Kapseln kann eine gezielte Freisetzung im Dünndarm erzielt werden, ähnlich wie bei Natriumbutyrat. Dank der einzigartigen Struktur von Tributyrin wird das Butyrat jedoch langsam freigesetzt und kann so größere Teile des Darms erreichen als herkömmliche Butyratsalze16.
Schlussfolgerung
Butyrat ist ein Eckpfeiler unserer Darm- und Systemgesundheit und beeinflusst unseren Stoffwechsel sowie neurologische und Immunfunktionen. Strategien zur Verbesserung der Butyrat-Produktion – einschließlich einer ballaststoffreichen Ernährung, eines gesunden Lebensstils und gezielter Supplementierung – bieten vielversprechende Ansätze zur Verbesserung des allgemeinen Wohlbefindens. Die laufende Forschung hebt weiterhin das therapeutische Potenzial von Butyrat hervor und unterstreicht die Bedeutung der Butyrat-produzierenden Darmmikroben für unsere Gesundheit. Tributyrin und Butyrat-Salze bieten sich durch geeignete Freisetzungsprofile als effektive Optionen für die Butyrat-Supplementierung an.
Referenzen (Englisch)
- Visconti A, Le Roy CI, Rosa F, Rossi N, Martin TC, Mohney RP, et al. Interplay between the human gut microbiome and host metabolism. Nat Commun. 2019 Oct 3;10(1):4505.
- Diener C, Dai CL, Wilmanski T, Baloni P, Smith B, Rappaport N, et al. Genome–microbiome interplay provides insight into the determinants of the human blood metabolome. Nat Metab. 2022 Nov 10;4(11):1560–72.
- Reider SJ, Moosmang S, Tragust J, Trgovec-Greif L, Tragust S, Perschy L, et al. Prebiotic Effects of Partially Hydrolyzed Guar Gum on the Composition and Function of the Human Microbiota—Results from the PAGODA Trial. Nutrients. 2020 Apr 28;12(5):1257.
- De Vos WM, Tilg H, Van Hul M, Cani PD. Gut microbiome and health: mechanistic insights. Gut. 2022 May;71(5):1020–32.
- Hodgkinson K, El Abbar F, Dobranowski P, Manoogian J, Butcher J, Figeys D, et al. Butyrate’s role in human health and the current progress towards its clinical application to treat gastrointestinal disease. Clin Nutr. 2023 Feb;42(2):61–75.
- Byndloss MX, Olsan EE, Rivera-Chávez F, Tiffany CR, Cevallos SA, Lokken KL, et al. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion. Science. 2017 Aug 11;357(6351):570–5.
- Bhutta NK, Xu X, Jian C, Wang Y, Liu Y, Sun J, et al. Gut microbiota mediated T cells regulation and autoimmune diseases. Front Microbiol. 2024 Dec 19;15:1477187.
- Peng K, Dong W, Luo T, Tang H, Zhu W, Huang Y, et al. Butyrate and obesity: Current research status and future prospect. Front Endocrinol. 2023 Feb 24;14:1098881.
- Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol. 2020 Jan 31;11:25.
- Sun J, Chen S, Zang D, Sun H, Sun Y, Chen J. Butyrate as a promising therapeutic target in cancer: From pathogenesis to clinic (Review). Int J Oncol. 2024 Feb 29;64(4):44.
- Wang R, Cao S, Bashir MEH, Hesser LA, Su Y, Hong SMC, et al. Treatment of peanut allergy and colitis in mice via the intestinal release of butyrate from polymeric micelles. Nat Biomed Eng. 2022 Dec 22;7(1):38–55.
- Ren Y, Wu J, Wang Y, Zhang L, Ren J, Zhang Z, et al. Lifestyle patterns influence the composition of the gut microbiome in a healthy Chinese population. Sci Rep. 2023 Sep 2;13(1):14425.
- Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, et al. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
- Kelly CJ, Zheng L, Campbell EL, Saeedi B, Scholz CC, Bayless AJ, et al. Crosstalk between Microbiota-Derived Short-Chain Fatty Acids and Intestinal Epithelial HIF Augments Tissue Barrier Function. Cell Host Microbe. 2015 May;17(5):662–71.
- Salvi PS, Cowles RA. Butyrate and the Intestinal Epithelium: Modulation of Proliferation and Inflammation in Homeostasis and Disease. Cells. 2021 Jul 14;10(7):1775.
- Yang N, Lan T, Han Y, Zhao H, Wang C, Xu Z, et al. Tributyrin alleviates gut microbiota dysbiosis to repair intestinal damage in antibiotic-treated mice. Abd El-Hamid MI, editor. PLOS ONE. 2023 Jul 31;18(7):e0289364.