Enzyme für die Verdauung bei funktionellen Darmerkrankungen wie Reizdarm und Co.

Keine Blähungen, Magenkrämpfe oder Bauchschmerzen mehr! Es gibt eine Vielzahl von Enzympräparaten – aber können sie wirklich das halten, was sie versprechen? In diesem Artikel gehen wir auf die Grundlagen der Enzyme und daraus abgeleiteter Präparate ein und stellen Studien vor, die den Einsatz von Verdauungsenzymen bei Reizdarmsyndrom und anderen Verdauungsstörungen untersuchen.
Lesezeit: 12 Minuten (Jede Minute lohnt sich 😊)
Hinweis: Wie immer sind die Informationen in unserem Artikel von uns selbst recherchiert und geschrieben – ohne Beteiligung von ChatGPT und Konsorten. Viel Spaß beim Lesen!
Was ist überhaupt ein Enzym?
In unserer Branche ist sehr häufig von Verdauungsenzymen die Rede. Doch wofür sind sie da und: brauchen wir sie überhaupt?
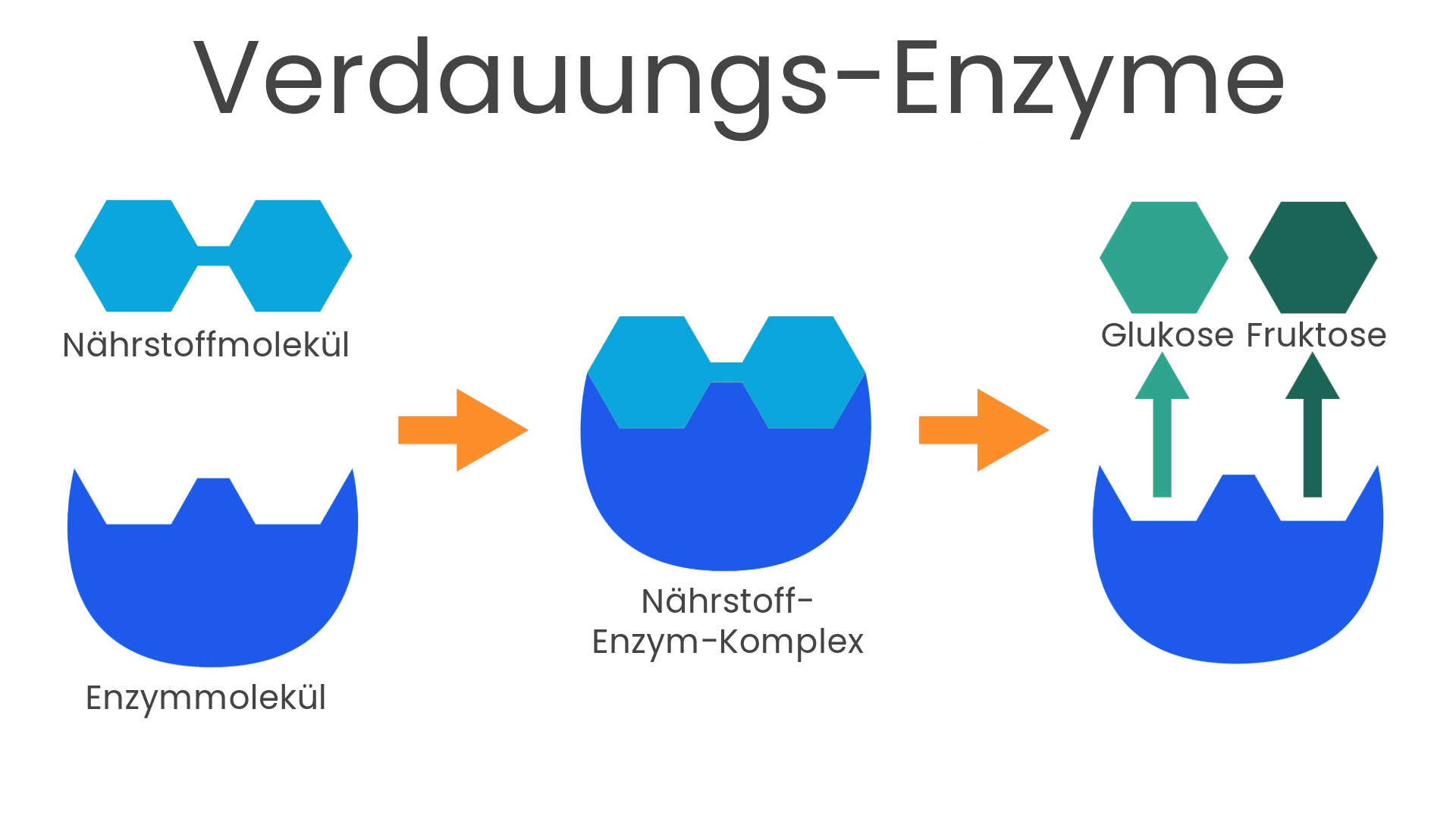
Verdauungsenzyme können mit Schlüsseln verglichen werden: Ihre Funktion ist, die in der Nahrung enthaltenen Nährstoffe aufzuschließen, damit der Körper sie aufnehmen kann.
So wie jeder Schlüssel auf ein bestimmtes Schloss passt, spalten Verdauungsenzyme in der Regel nur bestimmte Nährstoffe in kleinere, absorbierbare Moleküle. Diese Eigenschaft macht Enzyme auch für die industrielle Nutzung interessant, zum Beispiel zur Beseitigung von Ölverschmutzungen, zur Herstellung von Arzneimitteln und vielem mehr.
Verdauungsenzyme und Erkrankungen – wer kann von einer Supplementierung mit Enzymen profitieren?
Grundsätzlich erfordern nur bestimmte Krankheiten eine Supplementierung mit Enzymen. Beispiele sind Pankreatitis (Bauchspeicheldrüsenentzündung), die zu chronischer Pankreasinsuffizienz führen kann, zystische Fibrose oder die Entfernung der Gallenblase. Darüber hinaus kann eine Enzymeinnahme von Vorteil sein, wenn der Bürstensaum des Dünndarms keine ausreichenden Mengen an Laktase produziert, wie bei Laktoseintoleranz der Fall ist1.
Die Einnahme von Verdauungsenzymen kann auch eine große Erleichterung für Menschen sein, die unter Blähungen, Bauchkrämpfen und Völlegefühl aufgrund von Verdauungsstörungen leiden. Diese Symptome treten häufig im Zusammenhang mit funktioneller Dyspepsie (Reizmagen, Reizdarmsyndrom), SIBO (Dünndarmfehlbesiedlung) sowie Krankheiten wie Crohn und Colitis ulcerosa auf2. Interessanterweise wird vermutet, dass eine Pankreasinsuffizienz eine Ursache für SIBO sein kann, da SIBO bei 25-50 % der Patienten mit Pankreasinsuffizienz vorliegt1.
Weiterhin können Menschen, die an der gastroösophagealen Refluxkrankheit (GERD) leiden, von einer Nahrungsergänzung mit Verdauungsenzymen profitieren. GERD-Patienten erhalten häufig Protonenpumpenhemmer (PPI) oder Histamin-H2-Rezeptor-Antagonisten und leiden möglicherweise unter einer verminderten Proteinverdauung aufgrund einer Veränderung des pH-Werts im Magen und einer anschließenden Abnahme der Pepsinaktivität (Pepsin ist ein Verdauungsenzym).
Zu guter Letzt bringt das Altern Veränderungen in der Sekretion von Pankreasenzymen mit sich. Bereits im 3. Lebensjahrzehnt kann die Sekretion von Pankreasenzymen abnehmen3. Daher können Personen mit gastrointestinalen Symptomen ohne Grunderkrankung ab dem 30. Lebensjahr herum von einer Enzymsupplementierung profitieren.
Die verschiedenen Quellen von Verdauungsenzymen
Traditionell wird die Enzymersatztherapie mit Pankreatin durchgeführt. Pankreatin ist ein Enzymkomplex, der aus Amylase, Lipase und Protease besteht und so die Verdauung von Kohlenhydraten, Lipiden und Proteinen unterstützt. Dieser Enzymkomplex wird aus der Bauchspeicheldrüse von Schweinen gewonnen. Für diejenigen, die aus religiösen Gründen oder aus Gründen des Tierschutzes kein Schweinefleisch verzehren, kommt Pankreatin daher nicht in Frage. Da die Lipase in Pankreatin außerdem keine Säure verträgt, müssen die Enzyme ummantelt werden, damit sie die Magenpassage “überleben”.
Im Gegensatz dazu sind Enzyme aus mikrobiellen Quellen wie Pilzen und Bakterien in der Regel säuretoleranter, in geringerer Dosierung wirksam und müssen nicht umhüllt werden, um ihre Wirkung in den verschiedenen Teilen des Verdauungssystems zu entfalten4,5.
Wann bietet sich ein Nahrungsergänzungsmittel mit Verdauungsenzymen an?
Im besten Fall überhaupt nicht. Im Vergleich zu oftmals überteuerten Enzympräparaten gibt es günstiger und bessere Strategien zur Behandlung von Verdauungsstörungen. Bevor Du also keine Grundlage für eine gesunde Verdauung mit guten Routinen geschaffen hast, spare Dir lieber das Geld für Nahrungsergänzungsmittel! (Den Spoiler dazu gibt es ein wenig weiter unten…)
Hier ist eine kleine Liste von Vorschlägen, die Du zuerst ausprobieren solltest, um vorliegende Symptome im Zusammenhang mit der Verdauung zu verbessern:
-
Gründlich kauen
Nimm’ Dir Zeit, das Essen gründlich zu kauen, denn das kann den Verdauungsprozess unterstützen und Deinen Magen entlasten.
-
Vermeide auslösende Nahrungsmittel
Nahrungsmittel und Getränke, die Verdauungsstörungen auslösen können, wie fettige oder würzige Speisen, Koffein, Alkohol und kohlensäurehaltige Getränke.
-
Stress reduzieren
Immer leichter gesagt, als getan, aber: Durch die Aktivierung des sympathischen Nervensystems kann Stress Verdauungssymptome verschlimmern. Die Anwendung von Techniken, die das parasympathische Nervensystem aktivieren, wie z. B. tiefe Atmung, Meditation oder Achtsamkeit, kann zur Linderung der Symptome beitragen.
-
Ausreichend Schlaf
Schlechter und zu wenig Schlaf steigert den Stresspegel und erhöht die Wahrscheinlichkeit von Reflux und anderen Symptomen
Symptomlinderung bei Reizdarmsyndrom, SIBO, Dyspepsie und GERD – die richtigen Enzyme und Dosierungen sind entscheidend
Bei all den verschiedenen Enzympräparaten auf dem Markt mag es überraschen (oder auch nicht): Es gibt nur eine begrenzte Anzahl von Studien zur Wirkung von einzelnen Enzymen und Enzymmischungen bei den verschiedenen Darmerkrankungen. In diesem Abschnitt stellen wir einige der wichtigsten Ergebnisse aus Studien mit Menschen vor, um Dir verwertbare Erkenntnisse für Deine Auswahl des richtigen Präparats zu geben.
-
Alpha-Galaktosidase
Beginnen wir mit der α-Galaktosidase. Dieses Enzym hilft uns, ein häufiges FODMAP abzubauen – nämlich Galactooligosaccharide (GOS). Obwohl GOS für ihre präbiotische Wirkung im menschlichen Darm bekannt ist, ist sie bei vielen Patienten mit Reizdarmsyndrom oder SIBO einer der häufigsten Symptomauslöser. Daher könnte die gezielte Unterstützung zum Verdauen von GOS zu Beginn der Behandlung von Reizdarm und SIBO förderlich sein.
Obwohl α-Galaktosidase in mehreren Enzympräparaten enthalten ist, wird sie oft nicht richtig dosiert. In einer Studie aus dem Jahr 2018 testeten Forscher der Monash-Universität in Australien zwei verschiedene Dosierungen von α-Galaktosidase bei Reizdarmpatienten, die GOS nicht gut vertrugen. Nur eine Dosis von 300 Aktivitätseinheiten war in der Lage, die Symptome ausreichend zu reduzieren, während die Hälfte der Dosis kaum Erleichterung brachte6.
Eine frühere Studie aus dem Jahr 2007 untersuchte die Reaktion auf entweder 300 oder 1.200 Aktivitätseinheiten α-Galaktosidase nach einer Testmahlzeit von 420 g gekochten Bohnen im Vergleich zu einem Placebo. Die Autoren kamen zu dem Schluss, dass α-Galaktosidase bei Patienten mit blähungsbedingten Symptomen wie übermäßiger Flatulenz nach GOS-reichen Mahlzeiten hilfreich sein kann. Sie stellten fest, dass 1.200 Aktivitätseinheiten die Ausscheidung von Wasserstoff in der Atemluft und Blähungen wirksamer reduzierten als 300 Aktivitätseinheiten, wobei jedoch beide Dosierungen die Gesamtsymptome signifikant verringerten7.
Da empfindliche Personen nur selten 420 g gekochter Bohnen essen würden, sollte die mittlere Dosis von 300 Aktivitätseinheiten ausreichen, blähungsbedingte Symptome nach einer Mahlzeit wirksam zu reduzieren.
-
Beta-Galaktosidase (Laktase)
Ein weiteres Enzym, das das Potential für eine Linderung von Symptomen aufweist, ist β-Galaktosidase, also Laktase. Dieses Enzym wird vom Bürstensaum des Dünndarms produziert und hilft uns, Laktose (ein weiteres FODMAP) abzubauen. Viele Patienten mit Reizdarmsyndrom leiden auch an einem durchlässigen Darm (Leaky Gut), was die Laktaseproduktion des Darms negativ beeinflussen kann. Im Allgemeinen wird auch mit zunehmendem Alter weniger Laktase produziert.
In den meisten Humanstudien wird die Laktasesupplementierung bei tatsächlich laktoseintoleranten Personen getestet. Je nach Beschichtung des Enzyms kann eine Dosierung von bis zu 3.000 Aktivitätseinheiten Laktase beim Verzehr von bis zu 20 g Laktose Linderung verschaffen, so die Forschungsergebnisse8.
-
Protease
Unverdaute Proteine und größere Peptide können Entzündungsreaktionen hervorrufen, die wiederum den Teufelskreis von Darmentzündungen und erhöhter Durchlässigkeit aufrecht erhalten. Der Grund dafür kann eine geringe Magensäureproduktion, PPI, falsches Kauen, Stress oder ein Mangel an Pankreasenzymen sein. In solchen Fällen kann die Zufuhr von Proteasen – Enzyme, die bei der Verdauung von Proteinen helfen – Linderung verschaffen und diesen Teufelskreis durchbrechen.
Neben den Bauchspeicheldrüsenproteasen finden sich in Nahrungsergänzungsmitteln (NEMs) mit Verdauungsenzymen auch Proteasen pilzlichen, bakteriellen und pflanzlichen Ursprungs (Papaya und Ananas).
Obwohl Proteasen vorübergehend die Durchlässigkeit der Darmbarriere erhöhen9,10, können die Proteasen in Bromelain die Barriere der Darmschleimhaut verbessern, wie eine neuere Studie zeigt10. Darüber hinaus hat sich gezeigt, dass Bromelain die Dysmotilität (unzureichende Magenbewegung) verbessert, die mit der Pankreasinsuffizienz verbundenen Symptome lindert und die Zusammensetzung des Darmmikrobioms sowie die Produktion kurzkettiger Fettsäuren verbessert10. Bromelain und auch Papain sind daher häufige Quellen von Proteasen in NEMs.
Pilz- oder bakterielle Proteasen sind ebenfalls häufig in NEMs enthalten. Sie sind unter sauren Bedingungen stabil und werden in Varianten gefunden, die in verschiedenen pH-Bereichen wirksam sind. Die optimale Dosierung dieser Proteasen ist derzeit jedoch umstritten.
-
Lipase
Ein weiteres wichtiges Verdauungsenzym ist Lipase. Dieses Enzym wird normalerweise von der Bauchspeicheldrüse produziert und hilft uns, Fette zu verdauen. Es hat sich gezeigt, dass eine Dosierung von 1.000 Aktivitätseinheiten die Fettverdauung in vitro (außerhalb eines Organismus getestet) signifikant unterstützt4.
Bei Patienten mit RDS-D (diarrhöisch dominiertes Reizdarmsyndrom) wurden bei einer Untergruppe von Patienten niedrige Elastase-1-Werte (unter 100 µg/g) festgestellt, was auf eine Pankreasinsuffizienz hinweist11. Interessanterweise führte unter RDS-D-Patienten eine Supplementierung mit Pankreaslipase zu einer signifikanten Linderung der Symptome bei Patienten mit niedrigen Elastase-1-Werten12.
Einige Daten deuten jedoch darauf hin, dass Lipase nicht der Hauptverursacher der gastrointestinalen Symptome nach einer Mahlzeit ist. Da in diesen Studien Enzymkomplexe verwendet wurden, die entweder sehr geringe Mengen säurestabiler Lipasen oder unbeschichtete Pankreaslipase enthielten, die im Magen in hohem Maße abgebaut wird, wird vermutet, dass die erfahrene Symptomlinderung durch diese Enzymmischungen auf andere Enzyme als Lipase zurückzuführen ist. Daraus lässt sich schließen, dass eine komplexe Mischung von kohlenhydratabbauenden Enzymen für eine Symptomlinderung von Bedeutung ist11.
-
Phytase
Einige der in Getreide und anderen pflanzlichen Quellen enthaltenen Mineralien werden durch Phytat gebunden. Phytat bindet bspw. Kalzium, Eisen und Zink. Mit Hilfe des Enzyms Phytase können die von Phytat gebundenen Mineralien freigesetzt und absorbiert werden13. (Daher kommt auch die Hypothese, dass der Mineralstoffmangel in vielen Entwicklungsländern auf die Abhängigkeit von Getreide zurückgeführt werden kann.)
-
Xylanase
Xylane sind komplexe Kohlenhydrate, die mit Hilfe des Enzyms Xylanase abgebaut werden können. Durch die enzymatische Spaltung von Xylanen werden kürzere Ketten gebildet, die als Xylooligosaccharide bekannt sind. Diese sind intensiv auf ihre präbiotische Wirkung hin untersucht worden. So kann eine Supplementierung mit Xylanase dazu beitragen, den nützlichen Darmbakterien mehr der wichtigen Präbiotika bereit zu stellen.
Werbung in eigener Sache: Mibiota EASYibs liefert als präbiotischer Ballaststoff unseren nützlichen Bakterien genau diese wichtige Nahrung. Jetzt mehr erfahren! -
Glukose-Isomerase
Menschen, die unter Fruktoseintoleranz leiden, kann Glukose-Isomerase Lebensqualität zurückbringen. Mit einer magensäureresistenten Beschichtung kann dieses Enzym in den Dünndarm transportiert werden, wo es unverdaute Fruktose in Glucosemoleküle umwandelt.
-
Enzymmischungen
Bei einer Gruppe von Patienten mit funktioneller Dyspepsie konnte eine Mischung aus fünf mikrobiellen Enzymen, darunter Protease, Lipase, Amylase, Cellulase und Laktase, die dreimal täglich über einen Zeitraum von 60 Tagen eingenommen wurde, die gastrointestinalen Symptome im Vergleich zu einem Placebo deutlich verringern.
Die Interventionsgruppe umfasste achtzehn Teilnehmer, während die Placebogruppe neunzehn Teilnehmer umfasste. Interessanterweise berichteten fünf Patienten in der Placebogruppe über starke Magenschmerzen, Blähungen und Schmerzen beim Stuhlgang während der Studie; in der Behandlungsgruppe traten keine derartigen Symptome auf. Die Autoren kamen zu dem Schluss, dass diese Symptome in keinem Zusammenhang mit dem Placebo standen, sondern als Beweis für die Wirksamkeit der Enzymmischung gewertet werden konnten. Die Symptomwerte in der Behandlungsgruppe nahmen über den Studienverlauf allmählich ab und waren am Ende der Studie am niedrigsten. Eine längere Einnahme scheint daher vorteilhafter zu sein14.
Eine Mischung aus denselben Enzymen plus als Zusatz Kalzium zeigte in einer größeren randomisierten, kontrollierten klinischen Studie ebenfalls eine signifikante Verringerung der Dyspepsiesymptome im Vergleich zu einem Placebo. Die Enzymmischung wurde zwei Monate lang zweimal täglich vor den Hauptmahlzeiten eingenommen15. Da Kalzium bekanntermaßen die normale Funktion der Verdauungsenzyme unterstützt, lässt sich vermuten,dass Kalzium additive oder synergistische Wirkungen der Enzyme entfaltet.
Eine andere Enzymmischung, die Pankreatin tierischen Ursprungs sowie Cellulase, Protease und Amylase pilzlichen Ursprungs enthält, wurde zwei Wochen lang nach den Mahlzeiten eingenommen. Bei Patienten mit Dyspepsie verringerten sich Symptome wie Appetitlosigkeit, Blähungen, Aufstoßen, Durchfall, Bauchschmerzen und epigastrisches Brennen im Vergleich zu einem Placebo ebenfalls deutlich16. (Aufgrund des in dieser Mischung enthaltenen Pankreatins für Vegetarier und für Menschen, deren Religion den Verzehr von Schwein verbietet, allerdings nicht geeignet.)
Wirkung von Verdauungsenzymen auf die Darmmikrobiota
Da sich bei MIBIOTA alles um das Mikrobiom dreht, wäre dieser Artikel unvollständig, wenn wir nicht die Auswirkungen von NEMs mit Verdauungsenzymen auf die Darmmikrobiota untersuchen würden. Es gibt nur eine begrenzte Anzahl von Studien, die bisher genau dies untersuchen.
Es ist bekannt, dass eine eingeschränkte Funktion der Bauchspeicheldrüse das Darmmikrobiom erheblich verändert17,18. Diese Veränderungen können angeborene Immunreaktionen auslösen, die die Funktion der Bauchspeicheldrüse weiter beeinträchtigen.
In einer Studie aus dem Jahr 2018 stellte eine Gruppe von Forschern die Hypothese auf, dass eine Pankreatin-Supplementierung die Zusammensetzung des Mikrobioms und die Funktion der Bauchspeicheldrüse bei Mäusen verbessern könnte. Tatsächlich beobachteten sie ein Wachstum von Bakterien wie Akkermansia muciniphila und Lactobacillus reuteri, die bekanntermaßen ein gesundes Darmmilieu fördern, sowie eine Verringerung von entzündungsfördernden Bakterien19. Wir warten derzeit darauf, dass Studien an Menschen diese Hypothese bestätigen.
Zeitpunkt für die Einnahme von Verdauungsenzymen
In den oben beschriebenen Studien erfolgte die Supplementierung mit den Enzymen bzw. den Enzymmischungen zu unterschiedlichen Zeiten und Zeitpunkten. Die meisten Studien verfolgen die Strategie, unmittelbar vor oder mit Beginn einer Mahlzeit zu supplementieren. Wir würden dies ebenfalls empfehlen. Bei langen Mahlzeiten mit mehreren Gängen kann es notwendig sein, zweimal oder öfter zu supplementieren, je nach Dosierung der Enzyme und der Dosis der Präparate.
Wichtigste Erkenntnisse
- Verdauungsenzyme, die den Abbau von häufig vorkommenden FODMAPs wie GOS und Laktose unterstützen, müssen richtig dosiert werden
- Die Dauer der Enzymsupplementierung kann das Ausmaß der Symptomlinderung bestimmen
- Die Einnahme von Verdauungsenzymen kann Menschen mit Reizdarmsyndrom, SIBO, GERD, funktioneller Dyspepsie, Leaky Gut, Nahrungsmittelunverträglichkeiten und Darmentzündungen helfen
Zusammenfassung
Bei der Nahrungsergänzung mit Verdauungsenzymen ist die Art und Dosierung der verschiedenen Enzyme entscheidend für eine optimale Wirkung. Außerdem kann sich die Dauer der Enzymergänzung auf den Erfolg der Behandlung auswirken. Bei einigen Erkrankungen kann eine lebenslange Supplementierung erforderlich sein. Bei Verdauungsstörungen wie funktioneller Dyspepsie, GERD, Reizdarmsyndrom, SIBO sowie im Alter und bei chronisch entzündlichen Darmerkrankungen kann eine zweimonatige Supplementierung bereits ausreichen.
Für Vegetarier und aus religiösen Gründen (kein Schwein) bleibt die Einnahme von Enzymen pflanzlichen, pilzlichen und bakteriellen Ursprungs.
10. April 2024
Referenzen (Englisch)
- Ianiro G, Pecere S, Giorgio V, Gasbarrini A, Cammarota G. Digestive Enzyme Supplementation in Gastrointestinal Diseases. Curr Drug Metab. 2016;17(2):187–93.
- Spagnuolo R, Cosco C, Mancina RM, Ruggiero G, Garieri P, Cosco V, u. a. Beta-glucan, inositol and digestive enzymes improve quality of life of patients with inflammatory bowel disease and irritable bowel syndrome. Eur Rev Med Pharmacol Sci. Juni 2017;21(2 Suppl):102–7.
- Laugier R, Bernard JP, Berthezene P, Dupuy P. Changes in Pancreatic Exocrine Secretion with Age: Pancreatic Exocrine Secretion Does Decrease in the Elderly. Digestion. 1991;50(3–4):202–11.
- Garvey SM, Guice JL, Hollins MD, Best CH, Tinker KM. Fungal digestive enzymes promote macronutrient hydrolysis in the INFOGEST static in vitro simulation of digestion. Food Chem. August 2022;386:132777.
- Roxas M. The role of enzyme supplementation in digestive disorders. Altern Med Rev J Clin Ther. Dezember 2008;13(4):307–14.
- Tuck CJ, Taylor KM, Gibson PR, Barrett JS, Muir JG. Increasing Symptoms in Irritable Bowel Symptoms With Ingestion of Galacto-Oligosaccharides Are Mitigated by α-Galactosidase Treatment. Am J Gastroenterol. Januar 2018;113(1):124–34.
- Di Stefano M, Miceli E, Gotti S, Missanelli A, Mazzocchi S, Corazza GR. The Effect of Oral α-Galactosidase on Intestinal Gas Production and Gas-Related Symptoms. Dig Dis Sci. Januar 2007;52(1):78–83.
- Lin MY, Dipalma JA, Martini MC, Gross CJ, Harlander SK, Savaiano DA. Comparative effects of exogenous lactase (?-galactosidase) preparations onin vivo lactose digestion. Dig Dis Sci. November 1993;38(11):2022–7.
- Van Spaendonk H, Ceuleers H, Witters L, Patteet E, Joossens J, Augustyns K, u. a. Regulation of intestinal permeability: The role of proteases. World J Gastroenterol. 28. März 2017;23(12):2106–23.
- Kostiuchenko O, Kravchenko N, Markus J, Burleigh S, Fedkiv O, Cao L, u. a. Effects of Proteases from Pineapple and Papaya on Protein Digestive Capacity and Gut Microbiota in Healthy C57BL/6 Mice and Dose-Manner Response on Mucosal Permeability in Human Reconstructed Intestinal 3D Tissue Model. Metabolites. 26. Oktober 2022;12(11):1027.
- Graham DY, Ketwaroo GA, Money ME, Opekun AR. Enzyme therapy for functional bowel disease-like post-prandial distress. J Dig Dis. November 2018;19(11):650–6.
- Leeds JS, Hopper AD, Sidhu R, Simmonette A, Azadbakht N, Hoggard N, u. a. Some Patients With Irritable Bowel Syndrome May Have Exocrine Pancreatic Insufficiency. Clin Gastroenterol Hepatol. Mai 2010;8(5):433–8.
- Vashishth A, Ram S, Beniwal V. Cereal phytases and their importance in improvement of micronutrients bioavailability. 3 Biotech. Mai 2017;7(1):42.
- Majeed M, Majeed S, Nagabhushanam K, Arumugam S, Pande A, Paschapur M, u. a. Evaluation of the Safety and Efficacy of a Multienzyme Complex in Patients with Functional Dyspepsia: A Randomized, Double-Blind, Placebo-Controlled Study. J Med Food. November 2018;21(11):1120–8.
- Ullah H, Di Minno A, Piccinocchi R, Buccato DG, De Lellis LF, Baldi A, u. a. Efficacy of digestive enzyme supplementation in functional dyspepsia: A monocentric, randomized, double-blind, placebo-controlled, clinical trial. Biomed Pharmacother. Dezember 2023;169:115858.
- Ran ZH, Yuan YZ, Li ZS, Wang JY, Zong CH, Xie WF, u. a. The efficacy of Combizym in the treatment of Chinese patients with dyspepsia: a multicenter, randomized, placebo‐controlled and cross‐over study: SHANGHAI COMBIZYM CLINICAL COOPERATIVE GROUP. J Dig Dis. Februar 2009;10(1):41–8.
- Jandhyala SM, Madhulika A, Deepika G, Rao GV, Reddy DN, Subramanyam C, u. a. Altered intestinal microbiota in patients with chronic pancreatitis: implications in diabetes and metabolic abnormalities. Sci Rep. 3. März 2017;7:43640.
- Schepis T, De Lucia SS, Nista EC, Manilla V, Pignataro G, Ojetti V, u. a. Microbiota in Pancreatic Diseases: A Review of the Literature. J Clin Med. 17. Dezember 2021;10(24):5920.
- Nishiyama H, Nagai T, Kudo M, Okazaki Y, Azuma Y, Watanabe T, u. a. Supplementation of pancreatic digestive enzymes alters the composition of intestinal microbiota in mice. Biochem Biophys Res Commun. Januar 2018;495(1):273–9.