
BLOGARTIKEL
Der große Probiotika Guide – Von klassischen Stämmen bis hin zu Next-Generation Probiotika und Sporenbildnern
13. Februar 2026
Probiotika scheinen im wahrsten Sinne des Wortes in aller Munde zu sein. Probiotika: Diese lebenden Mikroorganismen wie Bakterien und Hefen, die wir uns in Kapselform zuführen, um unser Darmmikrobiom anzureichern, unsere Verdauung zu verbessern, unser Immunsystem zu unterstützen oder das Wachstum schädlicher Bakterien zu hemmen. Können sie überhaupt halten, was sie Dir versprechen?
Dieser Guide soll Dir helfen zu verstehen, worauf genau Du bei der Auswahl Deiner Probiotika achten solltest, und welche Rolle die sogenannten sporenbildenden Stämme spielen. Ziel ist es, Dir so viel Wissen an die Hand zu geben, wie Du Produktangaben einordnen und Probiotika eigenständig bewerten kannst, um eine zu Deiner individuellen Situation passende Entscheidung treffen zu können.
Hinweis: Wie immer sind die Informationen in unserem Artikel von uns selbst recherchiert und geschrieben – ohne Beteiligung von ChatGPT und Konsorten. Viel Spaß beim Lesen!
Was sind Probiotika?
Unser Darmmikrobiom besteht aus Milliarden von Mikroorganismen, die uns dabei helfen, Nährstoffe zu verwerten, Vitamine zu bilden, die Darmbarriere zu stabilisieren und das Immunsystem zu steuern. Gerät das mikrobielle Gleichgewicht im Darm (aber auch überall dort, wo wir noch Schleimhäute haben) aus der Balance – zum Beispiel durch Stress, Antibiotika oder eine einseitige Ernährung –, wird dies mit Verdauungsbeschwerden, Infektionen und chronischen Entzündungen in Verbindung gebracht.
Hier rücken nun die Probiotika in den Fokus, die die Darmmikrobiota unterstützen, anreichern und ergänzen sollen. Gleichzeitig soll erwähnt werden, dass nicht jedes probiotische Produkt automatisch wirksam ist. Entscheidend für den Erfolg sind die konkrete Bakterienart, der Stamm, die Dosierung und die vorhandene Evidenz. Eine schlechte Wahl der Probiotika kann bestehende Symptome sogar verschlimmern.
In den letzten Jahren hat sich der Blick von den bewährten Probiotika “der ersten Generation” hin zu sogenannten Probiotika “der zweiten Generation” erweitert. Zu dieser zweiten Generation zählen die neuartigen sporenbildenden Bakterien: Diese Stämme unterscheiden sich in ihrer Stabilität, wie gut sie den Magen-Darm-Trakt überleben sowie ihren Wirkmechanismen. Dadurch eröffnen sie potenziell neue therapeutische Möglichkeiten. Gleichzeitig stellen sie Dich vor eine noch größere Auswahl – jetzt nicht den Mut verlieren, sondern weiterlesen😊!
Klassische Bakterienstämme wie Lactobacillus- und Bifidobacterium-Arten gehören zu den Probiotika der ersten Generation – sie werden typischerweise in hoher Menge und recht unspezifisch verabreicht. Aber bedeutet mehr, wirklich besser?
Drei Gruppen von Probiotika
- Probiotika der ersten Generation (klassische Milchsäurebakterien)
- Probiotika der zweiten Generation (z. B. sporenbildende Bacillus Stämme, verkapselte Stämme)
- Next Generation Probiotika (neu identifizierte Mikrobiom Schlüsselorganismen)
Probiotika: Je mehr, desto besser?
Probiotika der ersten Generation bilden die „Klassiker“ unter den probiotischen Präparaten: Es handelt sich meist um Milchsäurebakterien wie Lactobacillus und Bifidobacterium-Arten sowie einzelne, gut charakterisierte Stämme von Escherichia coli. Auch Hefen wie Saccharomyces boulardii, die seit vielen Jahren in Lebensmitteln und Nahrungsergänzungsmitteln eingesetzt werden, zählen zur ersten Generation. Sie werden oft als sicher für die Gesundheit angesehen, weil sie entweder natürlicherweise Teil der menschlichen Darmflora sind oder seit Jahrzehnten ohne relevante gesundheitliche Risiken eingenommen werden. Die Probiotika der ersten Generation zeichnen sich weiter durch ihre Robustheit aus, bzw. es besteht viel Wissen über ihre Stabilität im Verdauungstrakt, speziell zu ihrer Säurebeständigkeit. So wurden einige Lactobacillen in einem Modell des oberen Verdauungstraktes getestet, mit dem Ergebnis einer guten Überlebensrate, insbesondere beim Verzehr zusammen mit Milch1.
Besonders häufig werden die Vertreter der ersten Generation aktuell bei infektiösen Diarrhöen oder antibiotika-assoziierter Diarrhö eingesetzt. Hier wird seit längerem vermutet, die lebenden Mikroben könnten nach Eradikation durch Antibiotikagabe zu einer schnelleren Wiederherstellung des Darmmilieus beitragen.
Relevante Vertreter der ersten Generation von Probiotika
- Lactobacillus spp.: z. B. L. rhamnosus (inkl. GG), L. plantarum, L. paracasei, L. casei, L. acidophilus
- Bifidobacterium spp.: z. B. B. longum, B. bifidum, B. breve, B. animalis subsp. lactis
- Weitere, z. B. S. thermophilus, Bacillus coagulans sowie S. boulardii
Eben dies scheint eine Studie zu widerlegen: Ein Forscherteam zeigte 2018, dass ein Standard-Probiotikum mit mehreren Stämmen, wie es in der Praxis oftmals verabreicht wird, die Erholung nach der Antibiotikagabe sogar ausbremste und ein abwartender Behandlungsansatz erfolgreicher war2. In der Studie wurden diese beiden Ansätze mit einem dritten Ansatz verglichen, und zwar der autologen Stuhltransplantation, welche von allen drei Ansätzen am besten abschnitt. Die autologe Stuhltransplantation gründet auf den neueren Erkenntnissen, dass jeder Mensch ein individuelles Mikrobiom besitzt, welches nicht gleich auf Interventionen anspricht und nicht einfach mit Gabe von Probiotika in großen Mengen (wieder) ins Gleichgewicht gebracht werden kann. Dies dürfte auch eine Erklärung für die teilweise stark schwankende Effektivität von klassischen Probiotika der ersten Generation sein.
Klassische Probiotika nur mit geringfügigem langfristigem Nutzen
Weiterhin zu beachten ist eine häufig beobachtete schlechte Persistenz der klassischen Probiotika im Darm – oft passieren sie den Verdauungstrakt lediglich flüchtig und führen zu keiner langfristigen Kolonisation, weil sie beispielsweise durch die Magensäure bereits zu stark geschädigt wurden. Das beschreibt auch eine Studie aus dem Jahr 20183: Gesunde Probanden erhielten ein Probiotikum mit elf Stämmen (Lactobacillus-, Bifidobacterium-, Lactococcus-, Streptococcus-Stämme) oder ein Placebo, wobei wiederholt Endoskopien mit Biopsien aus Dünn- und Dickdarmschleimhaut sowie Stuhlproben durchgeführt wurden.
Neben der klassischen Mikrobiomdiagnostik wurden auch moderne Verfahren wie die Metagenomik genutzt, um die Kolonisation und die Effekte auf die Genexpression einzuordnen. So zeigte sich, dass probiotische Stämme die Schleimhaut, wenn überhaupt, nur transient und in stark personenabhängigen Mustern besiedelten. Die Probanden konnten dabei in „permissive“ und „resistente“ Gruppen einsortiert werden, wobei permissive Typen die Besiedlung eher zuließen. Dennoch war die Kolonisation nicht anhaltend und sank signifikant auf das Ausgangsniveau zurück, sobald die Einnahme beendet wurde. Das bedeutet: „One-size-fits-all“-Probiotika sind funktionell problematisch. Ob und wie sie wirken, hängt stark von der individuellen Mukosabiologie und der vorhandenen Mikrobiota ab. Klassische Probiotika haben demnach möglicherweise nur einen geringfügigen langfristigen Nutzen.
Perspektivisch sprechen die Daten für personalisierte, mikrobielle Interventionen beziehungsweise eine Verbesserung der Anwendungen von Probiotika. Die tatsächliche Evidenz zu den Probiotika der ersten Generation ist also nicht so blumig, wie oft gerne angepriesen wird. Wie sieht es denn aber mit den Probiotika der zweiten Generation aus, die spezifischer wirken und besser zu verabreichen sein sollen?
Probiotika der zweiten Generation: Besser durch neue Technologien
Das Problem der ersten Generation – die teilweise schwankende Stabilität, besonders im trockenen Zustand, sowie die schlechte Ansiedlung – wird bei der zweiten Generation adressiert. Die Bakterien werden hier über moderne Verkapselungstechnologien besser konserviert und können sich daher eher ansiedeln. Die sporenbildenden Bakterien nutzen eben diese Technologie, was sie sehr resistent gegenüber der Magensäure macht und sie sich sozusagen im Darm selbst “wiederbeleben” können – dazu gleich mehr.
Strategien, um die Effektivität der klassischen Probiotika zu verbessern, sind beispielsweise die Mikroverkapselung, Mehrschicht-Kapseln, und magensaftresistente Kapseln. Dadurch können wir von dem recht unspezifischen “viel hilft viel, Hauptsache es kommt etwas an” abrücken und eine gezieltere Auswahl sinnvoller Stämme mit einer präziseren Dosis für das Therapieziel anvisieren – und wenn ein Stamm sich tatsächlich ansiedeln kann, können auch Therapieeffekte in Studien besser untersucht werden.
Saccharomyces boulardii
Die Hefe überlebt Magen- und Gallensäuren nämlich deutlich besser als viele bakterielle Probiotika und bleibt in simulierten Magen/Darm-Bedingungen auch nach Stunden noch lebensfähig4.
Als Beispiel wollen wir uns die Hefe S. boulardii anschauen (siehe auch Box). Sie wird besonders bei Diarrhö, beispielsweise antibiotika-assoziierter Diarrhö eingesetzt, und unterstützt bei der Eradikation von Helicobacter pylori und Clostridium difficile5. Eine weitere Besonderheit ist, dass die Vorteile von S. boulardii vorübergehend und unabhängig von der Besiedlung des Darms zu sein scheinen, wodurch sich die Wirkungsweise von anderen weit verbreiteten bakteriellen Probiotika unterscheidet. Das Ausbleiben einer Besiedlung scheint mit der erwähnten Bindung von Krankheitserregern als Mechanismus zur Verhinderung der Besiedlung durch Krankheitserreger (bspw. C. difficile, H. pylori) zusammenzuhängen.
Ein weiteres Paradebeispiel für die Probiotika der zweiten Generation sind sporenbildende Probiotika. Was genau diese können, erklären wir Dir jetzt.
Funktionsweise und Vorteile von Sporenbildner
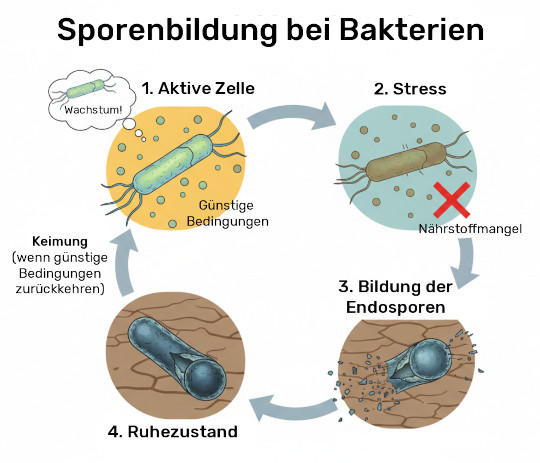
Sporenbildner haben im Gegensatz zu vielen anderen Bakterien den folgenden Weg zum Überleben gewählt: Sie bilden sogenannte Endosporen, die das bakterielle Genom mit einer Schutzhülle vor ungünstigen Lebensbedingungen wie Hitze oder Säure schützen. Verbessern sich die Lebensbedingungen wieder, erwecken die Sporen wieder zum Leben (genauer gesagt zum Wachstum). Die Sporenbildner entscheiden sich übrigens, ob sie einfach nur wieder mehr oder sogar bessere Sporen ausbilden.
Sporenbildende Probiotika, wie es einige Bacillus-Arten sind, gelten als technologisch weiterentwickelte, hochstabile Formen klassischer Probiotika. Dank ihrer Sporenform überstehen sie Hitze, Sauerstoff und Magensäure im Magen-Darm-Trakt deutlich besser als viele klassische Laktobazillen/Bifidobakterien. Typische Beispiele sind Bacillus coagulans, z. B. der LSBC-Stamm6, Bacillus clausii und Bacillus subtilis PLSSC7.
Existiert Evidenz für Sporenbildner bei Darmerkrankungen?
Verabreicht werden die inaktiven, “schlafenden” Sporen, damit sie sich in guten Konditionen wieder von selbst reaktivieren und im Dünn- und Dickdarm auskeimen. Zwar ist auch bei Sporenbildnern nicht sicher, dass diese sich dauerhaft ansiedeln. Es steht allerdings fest, dass die Sporenbildner besser im Darm ankommen und hier Enzyme zur Unterstützung der Verdauung produzieren können, antimikrobielle Stoffe zur Hemmung des Wachstums pathogener Keime bilden, und das Immunsystem beeinflussen, da sie von Makrophagen (Fresszellen) aufgenommen werden und dadurch Signalwege modulieren8.
So gibt es beispielsweise erste Evidenz zur Anwendung von B. coagulans LSBC bei der Behandlung des Reizdarmsyndroms9, wobei dieser Stamm die Symptome signifikant verbessern konnte. Auch die positive Veränderung der Darmmikrobiota von Reizdarmsyndrom-Patienten durch die Gabe von B. coagulans LSBC konnte in einer Studie gezeigt werden10.
Next-Generation Probiotika – Die Zukunft der therapeutischen Mikrobiota-Welt?
Als dritte Gruppe möchten wir Dir der Vollständigkeit halber noch die Next-Generation Probiotika vorstellen. Das ist eine neue Gruppe mit teils gezielt veränderten Mikroorganismen, die hoch spezifische Ansätze bieten.
Next-Generation Probiotika (NGP) sind im Gegensatz zur ersten Generation gezielt ausgewählte, meist erst durch moderne Mikrobiom-Analysen identifizierte Mikroorganismen. Sie sind oft strikt anaerob, also Organismen, die ohne Sauerstoff arbeiten und diesen auch nicht “vertragen”. Anders als klassische Lactobacillus/Bifidobacterium-Stämme sollen sie spezifische Mechanismen adressieren. In Studien wurden diese NGPs als Schlüsselfiguren des Mikrobioms identifiziert – so zeigen sie teils spezifische Gesundheits- bzw. Therapieeffekte.
Typische Kandidaten für die nächste Generation der Probiotika sind Akkermansia muciniphila, Faecalibacterium prausnitzii, Christensenella minuta, bestimmte Clostridien Cluster IV/XIVa (z. B. Anaerobutyricum, Roseburia), Bacteroides fragilis sowie weitere butyratbildende oder immunmodulierende Spezies.
Auch wenn diese Spezies einen hohen potenziellen Nutzen haben, sind sie teils noch nicht genug erforscht. Vor allem fehlt es an Daten zur Sicherheit sowie Langzeitstudien. Weiterhin sind die NGP sehr sensitiv gegenüber Sauerstoff und anderen Umweltfaktoren, weshalb der Einsatz sich aktuell noch schwierig gestaltet. Wir dürfen hier gespannt bleiben, was die Zukunft bringt: So könnte Akk. muciniphila ein Bestandteil der erweiterten Therapie einer Insulinresistenz oder eines Diabetes mellitus Typ 2 werden11.
Die Wahl des richtigen Probiotikums
Bei all den unterschiedlichen Generationen und Stämmen stellst Du Dir vielleicht die Frage: Woran erkennst Du ein sinnvolles Probiotikum – und welches passt zu Deiner Situation? Die folgenden Punkte sollen Dir dabei helfen, Produktangaben kritisch zu prüfen und Dir Deine Entscheidungsfindung zu erleichtern:
-
1. Klar definierte Stämme bevorzugen
Probiotische Effekte sind stammspezifisch: „Lactobacillus rhamnosus” sagt noch wenig aus, entscheidend ist die Kombination aus Art + Stammkennung (z. B. „L. rhamnosus GG“ oder „Bacillus coagulans LBSC“).
-
2. Gezielte Auswahl an Probiotikastämmen statt „Allzweckmischung“
Probiotika wirken nicht „für alles“ gleich gut. Eine wichtige Überlegung ist also: Wofür willst Du sie einsetzen?
- Akute oder antibiotikaassoziierte Durchfälle: Wähle eher Stämme wie Saccharomyces boulardii oder bestimmte Lactobacillus/Bifidobacterium-Stämme aus Studien in genau solch einem Aufbau
- Reizdarmsyndrom (RDS), Blähungen, funktionelle Beschwerden: Wähle Stämme, die in RDS-Studien getestet wurden (z. B. die beschriebenen sporenbildenden Bacillus Stämme)
- SIBO (Dünndarmfehlbesiedlung): Ursache für SIBO kann unter anderem ein erhöhter pH-Wert des Verdauungssystems sein – einige Probiotika, unter anderem Bacillus coagulans, können den pH-Wert reduzieren (Lese auch SIBO-Guide – Symptome, Diagnose und Ernährung bei Dünndarmfehlbesiedlung)
- Stoffwechselstörungen wie Insulinresistenz oder sehr spezifische Fragestellungen: Hier kommen eher kombinierte Strategien, bspw. Ernährung (Präbiotika) und ggf. Next-Generation Probiotika wie Akk. muciniphila infrage – reine „Breitbandmischungen“ sind dann selten die beste Wahl
-
3. Qualität der Formulierung und Dosierung
Für klassische Milchsäurebakterien sind magensaftresistente oder mehrfach verkapselte Präparate sinnvoll, damit die Bakterien überhaupt im Darm ankommen. Sporenbildner (z. B. Bacillus-Arten) und stabile Hefen wie S. boulardii brauchen weniger Schutz, dafür aber eine definierte Sporen- bzw. Zellzahl und gute Rohstoffqualität. Mehr Milliarden sind nicht automatisch besser: Entscheidend ist, dass die Dosierung zum untersuchten Bereich passt.
-
4. Verträglichkeit
Einige Bakterien können auch Stoffe bilden, die Deine Symptome unter Umständen verschlimmern können. Ein für viele problematischer Stoff ist Histamin, welches von vielen Probiotika gebildet werden kann (siehe zu Probiotika und Histamin auch unseren letzten Blogbeitrag). In genetischen Analysen dieser Bakterien kann getestet werden, wobei histaminfreundliche Zusammensetzungen oftmals extra gekennzeichnet sind. Auch Begleitstoffe können die Verträglichkeit der Probiotika beeinträchtigen, beispielsweise, wenn diese lange im Darm verbleiben und fermentiert werden, wobei Gase gebildet werden – das merkst Du dann anhand der auftretenden Blähungen.
Sind Probiotika sinnvoll nach Antibiotika?
Probiotika können nach einer Antibiotikatherapie sinnvoll sein. Das lässt sich allerdings nicht pauschal sagen. Antibiotika stören das Darmmikrobiom, und einige Probiotika können nachweislich das Risiko für antibiotikaassoziierte Durchfälle verringern und Beschwerden lindern. Untersucht sind unter anderem:
- Saccharomyces boulardii (Hefe), z. B. Stamm CBS 59212
- Alkalihalobacillus clausii 088AE13
Gleichzeitig zeigen neuere Studien, dass ein unspezifisches Standard Multistamm Probiotikum nach Antibiotika die natürliche Wiederherstellung der individuellen Darmflora sogar verzögern kann, während eine abwartende Strategie oder eine autologe Stuhltransplantation die ursprüngliche Mikrobiota schneller wiederherstellen zu vermögen. Praktisch heißt das: Wenn Du Probiotika nach einer Einnahme von Antibiotika nutzen willst, sollten sie aus klar definierten, gut untersuchten Stämmen bestehen.
Auch wenn Probiotika nach einer Antibiotikaeinnahme hilfreich sein können – sie ersetzen nicht die grundlegende Unterstützung durch eine richtige Ernährung und Ballaststoffe.
Sind sporenbildende Probiotika sicher?
Sporenbildende Probiotika gelten bei gesunden Menschen in der Regel als sicher – entscheidend ist immer der konkrete Stamm und die Qualität des Produkts. Bacillus-Stämme wie Bacillus coagulans (z. B. LBSC), Bacillus clausii oder Bacillus subtilis (z. B. PLSSC) werden gezielt ausgewählt, genetisch charakterisiert und auf Sicherheitsaspekte wie Toxin-Gene und problematische Antibiotikaresistenzen geprüft.
Seriöse Hersteller verwenden ausschließlich Stämme, deren Sicherheit in toxikologischen Tests, genomischen Analysen und – idealerweise – in Humanstudien bewertet wurde. Für Menschen mit stark geschwächtem Immunsystem, schweren Grunderkrankungen, intensivmedizinischer Behandlung oder zentralvenösen Kathetern sollte der Einsatz von Probiotika – inklusive sporenbildender Stämme – immer mit der behandelnden Ärztin bzw. dem Arzt abgesprochen werden.
Zusammenfassung
Probiotika sollten Bestandteil eines jeden holistischen Behandlungskonzepts sein. Ein sinnvolles Probiotikum passt zu Deinem Ziel (z. B. Durchfall, RDS, begleitende Unterstützung einer Therapie), enthält klar definierte Stämme in passender Dosierung, ist technologisch sinnvoll formuliert und stammt von einem Hersteller, der transparent mit Studienlage und Sicherheit umgeht. Wenn Du diese Punkte im Hinterkopf behältst, wird aus der unübersichtlichen Probiotika-Landschaft ein deutlich klareres Feld – und die Auswahl fällt Dir leichter. Vergessen solltest Du außerdem nicht, dass die Ernährung und Deine Lebensgewohnheiten Deinen Darm und Deine Gesundheit wesentlich beeinflussen.
Referenzen (Englisch)
- Lo Curto, A., Pitino, I., Mandalari, G., Dainty, J. R., Faulks, R. M., & John Wickham, M. S. (2011). Survival of probiotic lactobacilli in the upper gastrointestinal tract using an in vitro gastric model of digestion. Food microbiology, 28(7), 1359–1366. https://doi.org/10.1016/j.fm.2011.06.007
- Suez, J., Zmora, N., Zilberman-Schapira, G., Mor, U., Dori-Bachash, M., Bashiardes, S., Zur, M., Regev-Lehavi, D., Ben-Zeev Brik, R., Federici, S., Horn, M., Cohen, Y., Moor, A. E., Zeevi, D., Korem, T., Kotler, E., Harmelin, A., Itzkovitz, S., Maharshak, N., Shibolet, O., … Elinav, E. (2018). Post-Antibiotic Gut Mucosal Microbiome Reconstitution Is Impaired by Probiotics and Improved by Autologous FMT. Cell, 174(6), 1406–1423.e16. https://doi.org/10.1016/j.cell.2018.08.047
- Zmora, N., Zilberman-Schapira, G., Suez, J., Mor, U., Dori-Bachash, M., Bashiardes, S., Kotler, E., Zur, M., Regev-Lehavi, D., Brik, R. B., Federici, S., Cohen, Y., Linevsky, R., Rothschild, D., Moor, A. E., Ben-Moshe, S., Harmelin, A., Itzkovitz, S., Maharshak, N., Shibolet, O., … Elinav, E. (2018). Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell, 174(6), 1388–1405.e21. https://doi.org/10.1016/j.cell.2018.08.041
- Kabluchko, T. V., Bomko, T. V., Nosalskaya, T. N., Martynov, A. V., & Osolodchenko, T. P. (2017). Survival of microorganisms from modern probiotics in model conditions of the intestine. Annals of Mechnikov Institute, (1), 28-33. DOI: 10.5281/zenodo.401068. 28-33. 10.5281/zenodo.401068.
- Pais, P., Almeida, V., Yılmaz, M., & Teixeira, M. C. (2020). Saccharomyces boulardii: What Makes It Tick as Successful Probiotic?. Journal of fungi (Basel, Switzerland), 6(2), 78. https://doi.org/10.3390/jof6020078
- Saroj, D. B., & Gupta, A. K. (2020). Genome based safety assessment for Bacillus coagulans strain LBSC (DSM 17654) for probiotic application. International journal of food microbiology, 318, 108523. https://doi.org/10.1016/j.ijfoodmicro.2020.108523
- Dixit, Y., Bhingardeve, N., Inamdar, A., Saroj, D. (2024). In-Depth Functional Characterization of Bacillus subtilis PLSSC Revealing its Robust Probiotic Attributes. J Hum Nutr Food Sci 12(1): 1182. https://doi.org/10.47739/2333-6706/1183
- Bernardeau, M., Lehtinen, M. J., Forssten, S. D., & Nurminen, P. (2017). Importance of the gastrointestinal life cycle of Bacillus for probiotic functionality. Journal of food science and technology, 54(8), 2570–2584. https://doi.org/10.1007/s13197-017-2688-3
- Gupta, A. K., & Maity, C. (2021). Efficacy and safety of Bacillus coagulans LBSC in irritable bowel syndrome: A prospective, interventional, randomized, double-blind, placebo-controlled clinical study [CONSORT Compliant]. Medicine, 100(3), e23641. https://doi.org/10.1097/MD.0000000000023641
- Maity, C., Gupta PhD, A. K., Saroj, D. B., Biyani, A., Bagkar, P., Kulkarni, J., & Dixit, Y. (2021). Impact of a Gastrointestinal Stable Probiotic Supplement Bacillus coagulans LBSC on Human Gut Microbiome Modulation. Journal of dietary supplements, 18(6), 577–596. https://doi.org/10.1080/19390211.2020.1814931
- Depommier, C., Everard, A., Druart, C., Plovier, H., Van Hul, M., Vieira-Silva, S., Falony, G., Raes, J., Maiter, D., Delzenne, N. M., de Barsy, M., Loumaye, A., Hermans, M. P., Thissen, J. P., de Vos, W. M., & Cani, P. D. (2019). Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nature medicine, 25(7), 1096–1103. https://doi.org/10.1038/s41591-019-0495-2
- Ehrhardt, S., Guo, N., Hinz, R., Schoppen, S., May, J., Reiser, M., Schroeder, M. P., Schmiedel, S., Keuchel, M., Reisinger, E. C., Langeheinecke, A., de Weerth, A., Schuchmann, M., Schaberg, T., Ligges, S., Eveslage, M., Hagen, R. M., Burchard, G. D., & Lohse, A. W. (2016). Saccharomyces boulardii to Prevent Antibiotic-Associated Diarrhea: A Randomized, Double-Masked, Placebo-Controlled Trial. Open forum infectious diseases, 3(1), ofw011. https://doi.org/10.1093/ofid/ofw011
- Maity, C., & Gupta, A. K. (2021). Therapeutic efficacy of probiotic Alkalihalobacillus clausii 088AE in antibiotic-associated diarrhea: A randomized controlled trial. Heliyon, 7(9), e07993. https://doi.org/10.1016/j.heliyon.2021.e07993








